次の①~⑥の実験を容器を密封せずに行った。
容器内の物質の質量について実験前と実験後をくらべて実験前のほうが大きいものをA,
実験後のほうが大きいものをB, 変化しないものをCとして番号を書きなさい。
ただし、実験はすべて過不足なく反応するものとする。
A( ) B( ) C( )
木炭を燃焼させた。
硫黄と鉄の粉末を混ぜて加熱したら、黒色の物質になった。
炭酸水素ナトリウムを加熱したら、性質の異なる白色の物質になった。
マグネシウムを燃焼させた。
うすい塩酸に水酸化ナトリウム水溶液を少しずつ加えていったら中性の水溶液になった。
酸化銀を加熱したら白色の物質になった。
銅を酸化させて反応後の質量をはかった。右のグラフがその結果である。
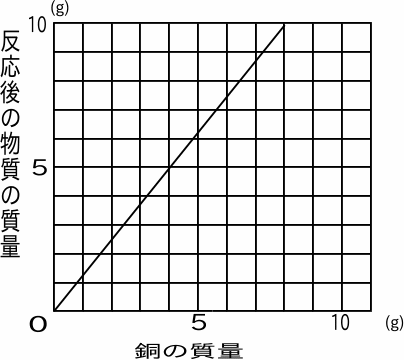 反応後の物質の名前を答えなさい。
反応後の物質の色は何色ですか。
この反応の化学反応式を書きなさい。
銅24gを完全に酸化させるのに必要な酸素は何gですか。
銅20gを加熱したところ、完全には酸化せずに、反応後の物質の質量は22gになりました。このとき反応せずに残った銅は何gでしょうか。
マグネシウムを加熱して反応後にできた物質の質量をはかった。その結果が下の表である。
アイウエオ
マグネシウム(g)3.06.010.015.021.0
反応後の物質(g)5.010.016.719.035.0
反応後の物質について答えなさい。
反応後の物質の名前を答えなさい。
反応後の物質の色は何色ですか。
この反応の化学反応式を書きなさい。
銅24gを完全に酸化させるのに必要な酸素は何gですか。
銅20gを加熱したところ、完全には酸化せずに、反応後の物質の質量は22gになりました。このとき反応せずに残った銅は何gでしょうか。
マグネシウムを加熱して反応後にできた物質の質量をはかった。その結果が下の表である。
アイウエオ
マグネシウム(g)3.06.010.015.021.0
反応後の物質(g)5.010.016.719.035.0
反応後の物質について答えなさい。
① 色は何色ですか。
② その物質は何という名前ですか。
③ その物質を7.5g得るには少なくとも何gのマグネシウムを加熱しなければなりませんか。
この実験の化学反応式を書きなさい。
ア~オの実験で1回だけ失敗してマグネシウムが完全に酸化しませんでした。
① それはどの実験ですか。記号で答えなさい。
② そのときに酸化せずに残ったマグネシウムの質量を求めなさい。
1.
A(① ③ ⑥)
B( ④ )
C(② ⑤)
2.
(1) 酸化銅
(2) 黒色
(3) 2Cu+O2→2CuO
(4) 6g
(5) 12g
3.
(1)
① 白色
② 酸化マグネシウム
③ 4.5g
(2) 2Mg+O2→2MgO
(3)
① エ
② 9.0g
1.
化学変化の前後で物質の質量の総和は変化しない。
化学変化の前後で物質の質量を全てはかれば、必ず同じになる。
ところが密閉していない容器で実験を行った場合、気体の質量が計れないので、
化学変化の前後で質量が変化する。
固体A + 気体B → 固体C + 固体D この場合 実験後の質量が重くなる。
固体A + 固体B → 固体C + 気体D この場合 実験後の質量は軽くなる
これをふまえてそれぞれの実験をみていくと
C+O2→CO2炭素
(固体) 酸素
(気体) 二酸化炭素
(気体)
実験後はすべて二酸化炭素(気体)になるので実験前が重いA Fe+S→FeS固体 固体 固体
実験前も後も気体は関係していないのでC 2NaHCO3→Na2CO3+CO2+H2O炭酸水素ナトリウム
(固体) 炭酸ナトリウム
(固体) 二酸化炭素
(気体) 水
(液体)
実験後に気体が発生するので実験前が重いA 2Mg+O2→2MgOマグネシウム
(固体) 酸素
(気体) 酸化マグネシウム
(固体)
空気中の酸素と結びつくので実験後が重いB NaOH+HCl→NaCl+H2O水酸化ナトリウム
(固体) 塩酸
(液体) 塩化ナトリウム
(固体) 水
(液体)
実験前も後も気体は関係していないのでC 2Ag2O→4Ag+O2酸化銀
(固体) 銀
(固体) 酸素
(気体)
実験後に気体が発生するので実験前が重いA
2Cu+O2→2CuO銅(赤褐色) 酸素 酸化銅(黒色)
グラフでx,yがともに整数となっている点を
読み取ると(4,5)または(10,8)である。
つまり4gの銅を酸化してできる酸化銅は5gである。
5-4=1より、そのとき結びつく酸素は1gとなる。
銅24gを酸化させる酸素をxとすると
4:1=24:x
x=6 答6g (5)
反応前20gで反応後22gとなっている。増えた2gは酸素である。
銅:酸素=4:1を用いて酸素2gと結びついた銅の質量を求める。
4:1=x:2
x=8
酸素2gと結びついた銅は8gである。
もともとあった銅は20gなので20-8=12
酸化せずに残っている銅は12gである。 3.
2Mg+O2→2MgOマグネシウム
(灰色) 酸素 酸化マグネシウム
(白色)
(1)①白色 ②酸化マグネシウム
(2)2Mg+O2→2MgO
表でマグネシウムと反応後の物質の比を求めると エ以外はすべて3:5となっている。
ここから(3)にある1回失敗した実験がエだと考えられる・・・(3)①
そしてマグネシウムと酸化マグネシウムの比は3:5とわかる。
マグネシウムをxとすると
3:5=x:7.5
x=4.5 (1)③4.5g
(3)エでは反応後の質量は4g増えている。マグネシウム:酸素=3:2の比をつかうと
3:2=x:4
x=6
つまり4gの酸素と結びつくマグネシウムは6gである。
エでは最初マグネシウムは15gあるので15-6=9
酸化せずに残ったマグネシウムは9gである。